Sabemos que existem três estados físicos da matéria: Sólido, líquido e gasoso; para entendermos as mudanças desses estados, primeiro vamos saber as diferenças entre eles.
- Estado Sólido: As substâncias apresentam formas definidas e seu volume não varia de forma considerável com variações de temperatura e pressão. As partículas que constituem o sólido encontram-se ligadas uma às outras por uma força de tração muito grande de modo que não podem movimentar-se livremente, vibrando apenas em posições fixas.
 Estado Líquido: As partículas que constituem o estado líquido não estão unidas fortemente, visto que deslizam uma sobre as outras, adaptando-se à forma do recipiente que as contém, mas estas forças de atração entre as partículas são suficientemente fortes para que não ocorra variação no volume e as partículas dificilmente podem ser comprimidas.
Estado Líquido: As partículas que constituem o estado líquido não estão unidas fortemente, visto que deslizam uma sobre as outras, adaptando-se à forma do recipiente que as contém, mas estas forças de atração entre as partículas são suficientemente fortes para que não ocorra variação no volume e as partículas dificilmente podem ser comprimidas.
 Estado Gasoso: As substâncias apresentam densidade menor que a dos sólidos e líquidos, ocupam todo o volume do recipiente que as contém, podem expandir-se indefinidamente e são comprimidas com grande facilidade. Este comportamento pode ser explicado pelas forças de atração entre as partículas muito fracas as quais possuem, portanto, alta mobilidade.
Estado Gasoso: As substâncias apresentam densidade menor que a dos sólidos e líquidos, ocupam todo o volume do recipiente que as contém, podem expandir-se indefinidamente e são comprimidas com grande facilidade. Este comportamento pode ser explicado pelas forças de atração entre as partículas muito fracas as quais possuem, portanto, alta mobilidade.
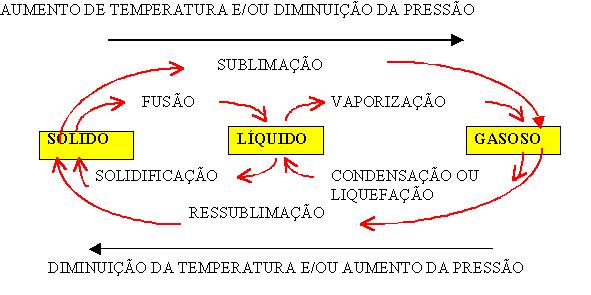
Depois disso, vamos as mudanças. A figura abaixo mostra as mudanças de estado físico da matéria.
- Fusão: Mudança do estado sólido para o líquido. Ex: Derretimento do gelo.
- Solidificação: Mudança do estado liquido para o sólido. Ex: O gelo, aquele que tem na sua casa dentro do freezer, é um exemplo de solidificação.
- Vaporização: Mudança do estado líquido para o gasoso. Ex: A água fervendo na panela.
- Condensação: Mudança do estado gasoso para o líquido. Ex: A água que fica no box do banheiro. Também o famoso "sereno da noite", a água que aparece "do nada" nos vidros dos carros, são um exemplo de condensação.
- Sublimação: Mudança do estado do sólido para o gasoso. Ex: Naftalina.
- Ressublimação: Mudança do estado gasoso para o sólido. Ex: Gelo seco.
Esse assunto é um dos básicos da Química, vamos dar continuidade com a matéria com substância pura e misturas. Até próximo post. Bons estudos!
Conhecimento virtual:
http://exercicios.brasilescola.com/quimica/exercicios-sobre-os-estados-fisicos-materia.htm Acesso em 03/06/2014.
http://www.sobiologia.com.br/conteudos/Oitava_quimica/materia10.php Acesso em 04/06/2014.



.jpg)
